Pourquoi les enfants contractent-ils une OMA?
L’OMA est extrêmement courante chez les enfants. En fait, 75 % des enfants en ont au moins un épisode avant l’âge d’un an [2]. Le mauvais fonctionnement et l’obstruction de la trompe d’Eustache sont les principales défaillances responsables de l’OMA. Les enfants sont plus prédisposés à l’OMA que les adultes, parce que leurs trompes d’Eustache sont plus courtes, sur un plan plus horizontal et plus susceptibles d’être obstruées par une hypertrophie des adénoïdes [3][4]. De plus, les infections virales et les allergies sont fréquentes chez les jeunes enfants, et ces deux problèmes peuvent provoquer une inflammation des trompes d’Eustache [5][6]. Enfin, les enfants (notamment ceux qui souffrent d’otites moyennes récurrentes) peuvent sécréter moins d’immunoglobuline A, un anticorps qui limite l’adhérence bactérienne au nasopharynx [7].
Une fois la trompe d’Eustache obstruée, deux phénomènes se produisent. D’abord, la clairance mucociliaire est perturbée, et le mucus reste coincé dans l’oreille moyenne [8]. Ensuite, la résorption des gaz dans l’oreille moyenne provoque une différence de pression, semblable à une pres-sion à vide, qui attire les bactéries du nasopharynx dans l’oreille moyenne. Après s’être introduites dans cet espace, les bactéries peuvent proliférer et provoquer une infection secondaire. Il est donc rare de contracter une OMA sans d’abord présenter une infection virale des voies respiratoires supérieures, l’OMA faisant généralement son apparition quelques jours après celle des symptômes viraux.
Certains enfants sont-ils plus vulnérables à l'OMA?
Les principaux facteurs de risque d’OMA sont le jeune âge et la fréquentation d’un milieu de garde. Le premier facteur est probablement lié à l’anatomie des trompes d’Eustache et à de faibles taux de sécrétion d’immunoglobuline A, tandis que le deuxième est lié à une exposition accrue aux infections virales, couplée à une plus grande incidence de colonisation nasopharyngée par des bactéries pathogènes. Les autres facteurs de risque sont les anomalies orofaciales (telles que la fente palatine), l’encombrement des maisons, l’exposition à la fumée secondaire, la prématurité, le non-allaitement, l’immunodéficience et des antécédents familiaux d’otite moyenne [9][10]. Les enfants d’origine inuite ou des Premières nations sont également plus vulnérables à l’OMA [11].
Comment diagnostique-t-on l'OMA?
Pour bien diagnostiquer l’OMA, il faut que du liquide se trouve derrière la membrane tympanique (une effusion de l’oreille moyenne) et constater des signes et symptômes précis d’inflammation de l’oreille moyenne (tableau 1), indiquant que le liquide est en fait du pus [12]-[22].
Si on diagnostique une OMA selon les critères du tableau 1, un traitement antimicrobien est-il indiqué?
Il est essentiel de comprendre l’étiologie de l’effusion et de l’inflammation aiguës de l’oreille moyenne pour répondre à cette question. Les virus jouent un rôle important dans la pathogenèse de l’OMA et peuvent constituer une cause directe d’OMA qui se résorbe spontanément, car on les trouve dans le liquide de l’oreille moyenne en l’absence de bactéries [23]. Cependant, les études [24][25] faisant appel à la tympanocentèse démontrent que la plupart du temps, des bactéries sont présentes. Les souches de bactéries ont changé au fil du temps. Avant l’utilisation du vaccin conjugué contre le pneumocoque, les principales bactéries isolées en cas d’OMA étaient le Streptococcus pneumoniae (selon une médiane de 42 % des cas), l’Haemophilus influenzae (selon une médiane de 31 % des cas) et le Moraxella catarrhalis (selon une médiane de 16 % des cas) [26]. Il était rare de constater la présence de streptocoque de groupe A, de Staphylococcus aureus et d’infections polymicrobiennes [27][28]. Depuis que le vaccin conjugué contre le pneumocoque est en marché, des études américaines ont permis d’évaluer les isolats bactériens des enfants vaccinés de moins de deux ans atteints d’une OMA grave ou réfractaire. Ils ont découvert que la proportion de cas d’OMA causés par le S pneumoniae a reculé de 48 % à 31 % tandis que celle des cas causés par un H influenzae non typable a augmenté de 41 % à 56 % [29]-[31].
Si l’état de l’enfant s’aggrave ou ne s’améliore pas pendant la période d’observation et que le diagnostic primaire semble tout de même être une otite moyenne aiguë, il faut commencer à administrer des antimicrobiens.
Plusieurs méta-analyses [32]-[34] ont porté sur le rôle des antimicrobiens dans le traitement de l’OMA. Comme on aurait pu le prédire d’une infection qui est essentiellement d’origine bactérienne, les données probantes cumulatives démontrent une résolution plus rapide des symptômes avec l’usage d’antimicrobiens. Cependant, l’effet du traitement sur les antimicrobiens est minime : il faut traiter une quinzaine d’enfants pour qu’un seul d’entre d’eux profite d’une résolution des symptômes (guérison clinique) au bout de 48 heures [32]. Les études qui ont donné lieu à ces conclusions ont toutefois été critiquées [35][36]. D’abord, dans la plupart d’entre elles, le diagnostic d’OMA était posé en clinique, ce qui laisse supposer la possibilité d’un mauvais diagnostic. Le même constat s’applique toutefois aux diagnostics d’OMA chez les enfants canadiens d’aujourd’hui. Ensuite, la guérison clinique était préférée à la guérison bactériologique comme issue primaire, en raison de la difficulté d’effectuer une tympanocentèse au départ et au suivi. Les enfants présentant une guérison bactériologique précoce sont moins susceptibles de souffrir d’une récurrence rapide de l’OMA par le même organisme, mais il semble qu’environ cinq enfants doivent profiter d’une guérison bactériologique pour prévenir une seule récurrence [37]. Enfin, le groupe témoin n’a pas toujours reçu de placebo. Malgré ces critiques, une résolution spontanée se produit dans la plupart des cas. Les enfants atteints d’une OMA ne devraient pas tous recevoir un traitement antimicrobien immédiat et, dans bien des cas, une attente vigilante et l’administration d’analgésiques peuvent suffire.
Quand est-il pertinent d'opter pour une attente vigilante?
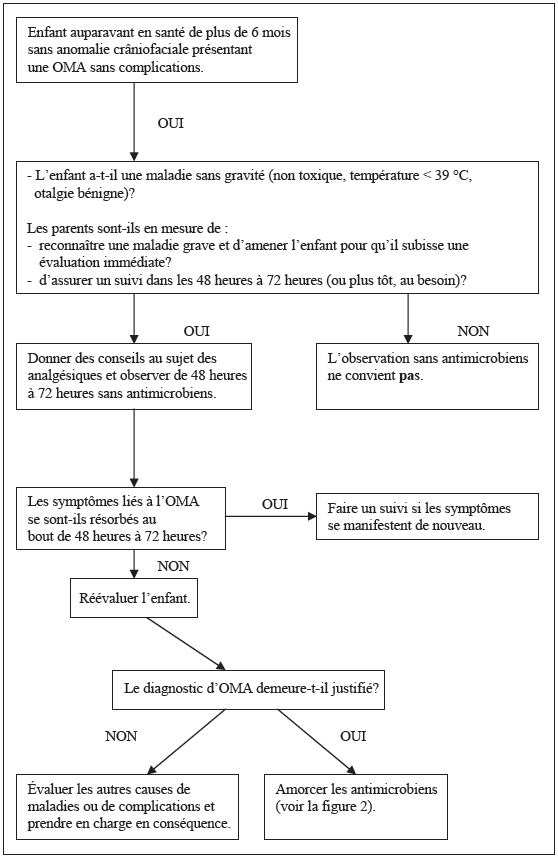
Si l’enfant a plus de six mois et que ses signes et symptômes sont légers, on peut opter pour une observation sans administration d’antimicrobiens pendant 48 heures à 72 heures s’il est possible d’assurer un suivi (tableau 2, figure 1) [38][39]. L’âge de six mois est déterminé comme le seuil minimal parce que les données sont limitées quant à cette démarche chez les enfants plus jeunes et qu’il est plus difficile de repérer une maladie grave chez ces enfants [40][41]. Si on choisit l’attente vigilante, il est vital de donner des conseils pertinents au sujet des analgésiques, l’acétaminophène et l’ibuprofène constituant les choix habituels. Il est recommandé de demander à la famille de revenir consulter si l’état de l’enfant ne s’améliore pas ou de lui remettre une prescription d’antimicrobiens qui pourra être remplie au gré des parents (prescription reportée). Les études [42][43] démontrent qu’il peut falloir légèrement plus de temps pour que les symptômes se résorbent lorsqu’on adopte l’attente vigilante, mais que les parents sont généralement satisfaits et qu’environ le tiers seulement des enfants finissent par recevoir des antimicrobiens.
L’attente vigilante ne convient pas aux enfants qui ont des symptômes graves (ils semblent toxiques, ont une otalgie importante ou une forte fièvre [plus de 39 °C, prise par la bouche]) [44]. Il est démontré que les enfants autochtones ont une incidence élevée d’otite moyenne suppurative, mais on ne sait pas si, chez ces enfants, l’attente vigilante accroît le risque de cette complication [11][45]. Néanmoins, il semblerait prudent de prescrire des antimicrobiens plus rapidement aux enfants autochtones.
Quels sont les risques de complications si la prise d'antimicrobiens est reportée ou n'est pas prescrite pour l'OMA?
Intuitivement, on peut penser que l’usage précoce d’antimicrobiens réduira l’incidence de graves complications de l’OMA, comme la mastoïdite, la méningite et les abcès intracrâniens. Aux Pays-Bas, où le taux de prescription d’antimicrobiens contre l’OMA correspond à environ 30 %, l’incidence de mastoïdite pédiatrique atteignait presque le double de celle observée dans les pays où les taux d’ordonnance dépassaient les 90 % [46]. Néanmoins, compte tenu de la rareté des cas de mastoïdite, les auteurs ont calculé qu’il faudra remplir au moins 2 500 ordonnances pour en prévenir un cas. Ils soulignent également qu’environ 25 % seulement des cas de mastoïdite exigent une mastoïdectomie et qu’environ la moitié des enfants ayant une mastoïdite présentent cette complication même s’ils ont déjà pris des antimicrobiens contre l’OMA [47]. Il n’existe pas d’études comparables sur d’autres complications suppuratives graves de l’OMA, mais encore une fois, il semble probable qu’il faudrait traiter des milliers d’enfants pour éviter une seule complication.
Des risques s’associent également à l’utilisation d’antimicrobiens. Environ 20 % des enfants font de la diarrhée, des complications comme le syndrome de Stevens-Johnson et l’anaphylaxie étant très rares mais mettant parfois la vie en danger. En outre, l’apparition d’organismes antibiorésistants découle principalement de la surutilisation d’antibiotiques.
En quoi la résistance influe-t-elle sur le choix d'un antimicrobien?
La résistance antimicrobienne au S pneumoniae est un problème au Canada et dans le monde. De plus, l’OMA découlant du S pneumoniae est la moins susceptible de se résorber spontanément (seulement 20 % des cas le font, par rapport à 50 % de ceux d’H influenzae) [48]. Dans certains cas, il est possible de repérer les enfants à risque d’infection par un S pneumoniae résistant aux antimicrobiens [49]. Les facteurs de risque incluent les enfants de moins de deux ans, qui fréquentent un milieu de garde (défini comme plus de quatre heures par semaine en compagnie d’au moins deux enfants non apparentés), qui ont souvent des otites moyennes ou qui ont utilisé des antimicrobiens récemment (dans les trois mois précédents) ou pour qui la thérapie antimicrobienne initiale contre l’OMA a échoué.
D’autres organismes s’associent à l’OMA, soit l’H influenzae et le M catarrhalis. Presque tous les isolats de M catarrhalis et environ le quart de ceux d’H influenzae produisent des bêta-lactamases [50]. Certains antimicrobiens bêtalactamines sont encore efficaces contre ces organismes, y compris des céphalosporines de deuxième et troisième générations et l’amoxicilline associée à un inhibiteur de bêtalactamase (comme le clavulanate). L’activité de la clarithromycine ou de l’azithromycine n’est pas touchée par une production de bêta-lactamase.
Quel est l'antimicrobien de choix contre l'OMA?
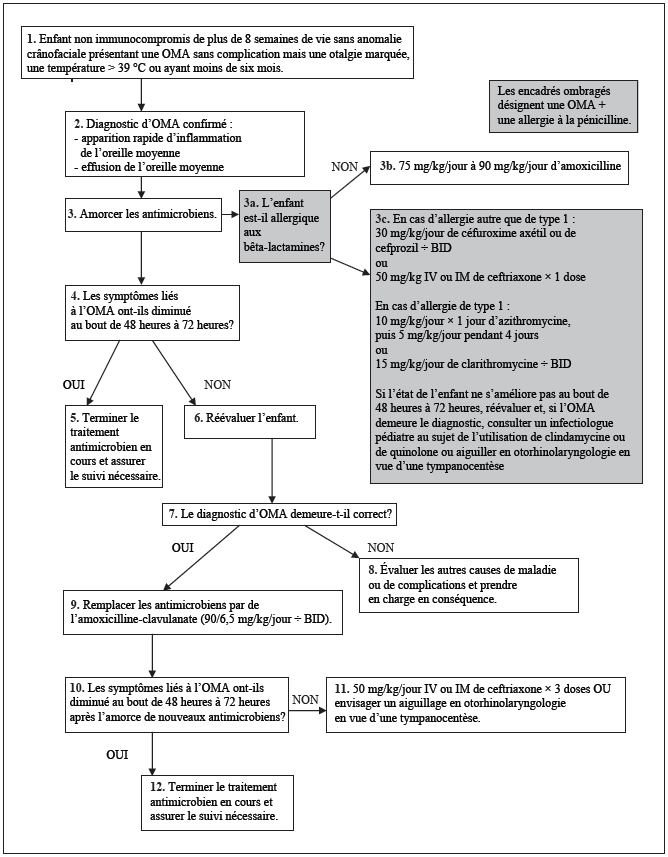
L’amoxicilline est la thérapie de choix chez un enfant sans allergies aux bêta-lactamines (figure 2). Aucun autre antimicrobien par voie orale n’a une efficacité supérieure contre l’OMA d’après les essais aléatoires. Ce médicament a une excellente pénétration de l’oreille moyenne (qui peut être efficace malgré une résistance in vitro), est peu coûteux et bien toléré et a un spectre antimicrobien relativement étroit [51]. Administré à une dose suffisante, c’est le médicament oral le plus susceptible d’être efficace contre le S pneumoniae pénicillinorésistant. Puisqu’on ne peut pas toujours établir si un enfant présente des facteurs de risque de résistance au S pneumoniae, il est recommandé aux médecins de prescrire de fortes doses d’amoxicilline, à hauteur de 75 mg/kg/jour à 90 mg/kg/jour. À cette dose, le médicament sera efficace contre les souches pénicillinorésistantes intermédiaires et peut-être même contre les souches hautement pénicillinorésistantes.

Si l’enfant a eu une réaction hypersensible de type 1 à l’amoxicilline ou à un autre antimicrobien bêta-lactamine (urticaire ou anaphylaxie systémique), on peut lui prescrire un macrolide (clarithronycine ou azithromycine). Si cette réaction à l’amoxicilline n’était pas de type 1, les céphalosporines de deuxième génération conviennent (tableau 3) [52]. Si l’enfant a eu une réaction hypersensible de type 1 à un antimicrobien bêta-lactamine et ne réagit pas aux macrolides, il faut envisager la clindamycine ou une quinolone, en consultation avec un infectiologue. On peut aussi orienter le patient en otorhinolaryngologie pour lui faire subir une tympanocentèse afin de déterminer l’agent étiologique responsable et d’orienter la thérapie [53].
Si l’enfant a eu une réaction hypersensible de type 1 à l’amoxicilline ou à un autre antimicrobien bêta-lactamine (urticaire ou anaphylaxie systémique), on peut lui prescrire un macrolide (clarithronycine ou azithromycine). Si cette réaction à l’amoxicilline n’était pas de type 1, les céphalosporines de deuxième génération conviennent (tableau 3) [52]. Si l’enfant a eu une réaction hypersensible de type 1 à un antimicrobien bêta-lactamine et ne réagit pas aux macrolides, il faut envisager la clindamycine ou une quinolone, en consultation avec un infectiologue. On peut aussi orienter le patient en otorhinolaryngologie pour lui faire subir une tympanocentèse afin de déterminer l’agent étiologique responsable et d’orienter la thérapie [53].
Si les symptômes ne se résorbent pas, faut-il changer d’antimibrobiens?
Les symptômes devraient s’atténuer le lendemain ou le surlendemain du début des antimicrobiens et se résorber au bout de deux ou trois jours. Les effusions de l’oreille moyenne, par contre, peuvent persister des mois, malgré leur résolution clinique et bactériologique. Par conséquent, la présence d’une effusion de l’oreille moyenne n’exige pas de modifier les antimicrobiens.
Cependant, si les symptômes n’ont pas disparu au bout de deux jours, il faut changer l’antimicrobien au profit d’un agent qui cible à la fois le S pneumoniae pénicillinorésistant et les organismes producteurs de bêta-lactamase. Parmi les possibilités, soulignons l’amoxicilline-clavulanate ou la ceftriaxone par voie parentérale (tableau 3) [54].
Il faut calculer la dose d’amoxicilline-clavulanate à 90 mg/kg/jour d’amoxicilline et à 6,4 mg/kg/jour de clavulanate, répartis en deux doses. Les méthodes pour parvenir à cette dose, qui exige de combiner de l’amoxicilline-clavu-lanate à de l’amoxicilline, figurent au tableau 4. Une préparation d’amoxicilline-clavulanate 14:1 est homologuée aux États-Unis, ce qui permet d’utiliser un seul médicament, mais elle ne l’est pas encore au Canada [55].
Quelle est la durée suffisante d’un traitement antimicrobien contre l’oma?
Un traitement antimicrobien de cinq jours à l’amoxicilline ou aux céphalosporines de deuxième génération est au moins aussi efficace qu’un traitement de dix jours chez les enfants de plus de deux ans atteints d’une OMA sans complication [56][57].
Certains enfants devraient-ils recevoir un traitement de dix jours contre l’OMA?
Un traitement antimicrobien de dix jours convient aux enfants de moins de deux ans, aux enfants ayant des récurrences fréquentes d’OMA ou une otite moyenne avec perforation de la membrane tympanique et à ceux qui n’ont pas réagi à un premier antimicrobien parce qu’ils sont plus vulnérables à un échec du médicament (il existe des exceptions à cette règle : l’azithromycine, pour laquelle il ne faut pas dépasser un traitement de cinq jours, et la ceftriaxone, pour laquelle une dose est généralement administrée aux cas sans complications et trois doses à ceux qui n’ont pas réagi au premier traitement) [58]-[65]. Les bienfaits du traitement plus long proviennent peut-être en partie du fait que l’enfant est dans un état « prophylactique » s’il contracte une nouvelle infection des voies respiratoires supérieures dans les dix jours suivant un diagnostic d’OMA. Cependant, si l’enfant présente des effets secondaires aux antimicrobiens dans les cinq à dix jours suivant le début de la prise des médicaments, il est raisonnable d’abandonner le traitement plutôt que de prescrire un autre antimicrobien.
Que peuvent faire les parents pour réduire le risque leur enfant contracte une OMA?
Pour limiter le risque que leur enfant contracte une OMA, les parents peuvent adopter des pratiques qui réduisent la possibilité de contracter une infection virale des voies respiratoires supérieures ou qui préviennent d’autres facteurs favorisant l’inflammation des trompes d’Eustache :
- Le respect de simples mesures d’hygiène comme l’hygiène des mains (après avoir touché à des sécrétions respiratoires, à des sécrétions nasales ou à des mouchoirs souillés) avec du savon ou un désinfectant pour les mains à base d’alcool peut avoir un effet positif sur la santé des familles à l’extérieur des milieux médicaux [66].
- L’allaitement exclusif jusqu’à l’âge d’au moins trois mois réduit l’incidence d’OMA, et cet effet persiste de quatre à 12 mois après la fin du sevrage [67]-[69]. Cette réduction est susceptible d’être secondaire aux immunoglobulines et à d’autres éléments du lait maternel qui renforcent l’immunité du nourrisson contre les pathogènes [70]. Cette réduction peut également être attribuable au fait que le bébé n’est pas nourri au biberon. En effet, lorsqu’un bébé est nourri au biberon (surtout si le biberon est appuyé pour le maintenir en position surélevée), la pression négative à l’intérieur du biberon incite le bébé à trop téter, ce qui produit une pression négative dans les trompes d’Eustache et favorise l’OMA. Cette situation ne se produit pas avec l’allaitement ou avec des biberons entièrement ventilés [71].
- L’utilisation de la suce chez les enfants de moins de trois ans accroît le risque d’otite moyenne aiguë de jusqu’à 25 %. Le risque semble lié à la fréquence de l’usage [72][73].
- Le fait de limiter l’exposition des très jeunes enfants aux milieux de garde réduit le risque d’infection des voies respiratoires supérieures et, par conséquent, d’OMA. Le risque est corrélé avec le nombre de contacts avec d’autres enfants plutôt qu’avec le nombre absolu d’enfants qui fréquentent le milieu de garde, et il est le plus élevé pendant la première année de vie [74].
- Il faut encourager les éducatrices en milieu de garde à adopter et à mettre en place des mesures d’hygiène des mains, de même que de nettoyage des jouets et du milieu. Dans une étude [75] portant sur 60 milieux de garde où on a insisté sur l’hygiène des mains, le nettoyage du milieu et le lavage plus fréquent des jouets et de la literie, le nombre d’infections des voies respiratoires supérieures a diminué de 26 % chez les enfants de moins de trois ans.
- Il faut éviter de fumer. Le tabagisme de la mère pendant la première année de vie est un facteur de risque important d’otite moyenne récurrente, notamment chez les nourrissons de petit poids à la naissance [76].
Quels vaccins offrent une protection contre l'OMA?
Le recours au vaccin contre l’influenza est fortement encouragé pour les enfants en santé de plus de six mois et pour leurs parents et leurs éducatrices [77]-[79]. L’influenza joue un rôle important dans la pathogenèse de l’OMA, et il est démontré que le vaccin contre l’influenza à virus inactivé offre une certaine protection contre l’OMA chez les tout-petits [80]-[82]. Même s’il n’est pas encore offert au Canada, le vaccin intranasal vivant atténué a une efficacité élevée (94 % à 98 %) dans la prévention de l’OMA associée à l’influenza chez les enfants de 15 à 71 mois [83][84].
Le vaccin conjugué contre le pneumocoque fait partie du calendrier de vaccination systématique de tous les enfants canadiens. Ce vaccin a une efficacité limitée contre l’OMA puisque seulement sept sérotypes pneumococciques en font partie, et de plus en plus de données probantes font état de « maladies de remplacement » par des sérotypes non vaccinaux [85][86]. Des études provisoires sur les prochains vaccins contre le pneumocoque conjugué en démontrent la meilleure efficacité contre l’OMA. Ils contiennent plus de sérotypes pneumococciques. Certains, conjugués à des éléments porteurs comme la protéine D de l’H influenzae, peuvent prévenir avec efficacité l’OMA causée par le pneumocoque et les souches non typées de l’H influenzae [87][88].
Recommandations
La qualité des preuves présentée dans les recommandations est tirée de l’évaluation des critères du Groupe d’étude canadien sur les soins de santé préventifs [89].
- Pour bien diagnostiquer l’OMA, il faut constater des signes d’effusion de l’oreille moyenne, une inflammation de l’oreille moyenne et une apparition aiguë des symptômes. Les signes d’effusion de l’oreille moyenne peuvent inclure une membrane tympanique immobile avec ou sans opacification, une perte des repères osseux ou une membrane tympanique rompue dont le conduit de l’oreille externe contient du liquide. Les signes d’inflammation de l’oreille moyenne sont une membrane tympanique bombée et décolorée. Les symptômes d’OMA sont une apparition rapide de douleur de l’oreille ou une irritabilité inexpliquée chez l’enfant qui ne sait pas encore parler (AII-2).
- Pour les enfants autrement en santé de plus de six mois qui n’ont pas d’anomalies crâniofaciales et dont les signes et symptômes cliniques sont bénins, on peut opter pour une attente vigilante pendant 48 heures à 72 heures s’il est possible d’assurer un suivi (BI). Il faut alors fournir des conseils au sujet des analgésiques. Il est recommandé de revoir la famille si l’état de l’enfant ne s’améliore pas ou de lui remettre une prescription d’antimicrobiens qui pourra être remplie selon les besoins (prescription reportée).
- S’il est décidé de traiter l’enfant à l’aide d’antimicrobiens, de fortes doses d’amoxicilline (75 mg/kg/jour à 90 mg/kg/ jour) constituent le traitement de choix contre l’OMA (AI/AII). Un traitement de cinq jours suffit pour la plupart des enfants de plus de deux ans, le traitement de dix jours étant réservé aux enfants plus jeunes (AI) ou à ceux qui sont atteints d’une OMA compliquée ou dont les récurrences sont fréquentes (AIII).
- Il faut informer les parents des facteurs susceptibles d’accroître le risque d’OMA chez leur enfant (BII-III).
- Il faut offrir le vaccin contre l’influenza (AII) et le vaccin conjugué contre le pneumocoque (AI) à tous les enfants en âge de les recevoir.
Signes d’effusion de l’oreille moyenne
|
Signes d’inflammation de l’oreille moyenne
|
Apparition aiguë des symptômes
|
| Les données sont adaptées des référence [12]-[22] |
L’observation pendant 48 heures à 72 heures sans antimicrobiens convient dans les situations suivantes :
|
Traitement de première ligne (pas d’allergie à la pénicilline)
|
Traitement de deuxième ligne
|
Si le traitement initial échoue (c’est-à-dire qu’on ne remarque aucune amélioration symptomatique au bout de deux à trois jours)
|
| *Consulter le texte pour obtenir les commentaires quant à la durée. Il ne faut jamais dépasser la dose pour adulte; †C’est une dose plus élevée qu’à l’habitude, choisie pour accroître la probabilité d’éradiquer les pneumocoques pénicillinorésistants. Si des doses plus faibles sont utilisées, une posologie trois fois par jour classique est plus pertinente. Certains experts recommandent une dose trois fois par jour pour la marge posologique la plus élevée; ‡Voir le tableau 4 pour connaître les doses d’amoxicilline associées à l’amoxicilline-clavulanate |
Tableau 4
Posologie d’amoxicilline-clavulanate associée à de l’amoxicilline pour obtenir 90 mg/kg/jour d’amoxicilline et 6,4 mg/kg/jour de clavulanate afin de soigner une otite moyenne aiguë qui n’a pas réagi au traitement antimicrobien initial
Posologie d’amoxicilline-clavulanate associée à de l’amoxicilline pour obtenir 90 mg/kg/jour d’amoxicilline et 6,4 mg/kg/jour de clavulanate afin de soigner une otite moyenne aiguë qui n’a pas réagi au traitement antimicrobien initial
| Médicament | Dose d’amoxicilline de l’amoxcilline-clavulanate | Dose d’amoxicilline à ajouter |
| Suspension de Clavulin-125F, de Clavulin-250F, de 125 mg d’Apo-Amoxi Clav ou de 250 mg d’Apo-Amoxi Clav, comprimés de Clavulin-500F ou de 500 mg d’Apo-Amoxi Clav (formules 4 :1) | 25 mg/kg/jour | 65 mg/kg/jour |
| Suspension de Clavulin 200 ou 400, comprimé de 875 mg de Clavulin ou d’Apo-Amoxi Clav (formules 7 :1) | 45 mg/kg/jour | 45 mg/kg/jour |
| Comprimé de Clavulin 250 ou de 250 mg d’Apo-Amoxi Clav (formules 2 :1) | 12,5 mg/kg/jour | 77,5 mg/kg/jour |
| Formules 14 :1 (pas encore homologuées au Canada) | 90 mg/kg/jour | Aucune |
| *La dose maximale totale d’amoxicilline est de 4 g (s’applique aux enfants de 45 kg ou plus) | ||
Figure 1) Organigramme de l’attente vigilante en cas d’otite moyenne aiguë (OMA)
Figure 2) Organigramme de traitement antimicrobiens de l’otite moyenne aiguë (OMA) (la dose ne doit jamais dépasser celle pour adulte) BID : deux fois par jour; IM : par voie intramusculaire; IV : par voie
intraveineuse
intraveineuse
COMITÉ DES MALADIES INFECTIEUSES ET D’IMMUNISATION
Membres : Robert Bortolussi MD (président); Jane Finlay MD; Joan L Robinson MD; Élisabeth Rousseau-Harsany MD (représentante du conseil); Lindy M Samson MD
Conseillères : Noni E MacDonald MD; Dorothy L Moore MD
Représentants : Upton D Allen MD, Groupe canadien de recherche sur le sida chez les enfants; Charles PS Hui MD, représentant de la SCP auprès de Santé Canada, comité consultatif de la médecine tropicale et de la médecine des voyages; Nicole Le Saux MD, Programme canadien de surveillance active de l’immunisation; Larry Pickering MD, American Academy of Pediatrics; Marina I Salvadori MD, représentante de la SCP auprès de Santé Canada, comité consultatif national de l’immunisation
Auteurs principaux : Sarah ED Forgie MD; George Zhanel MD; Joan L Robinson MD
Conseillères : Noni E MacDonald MD; Dorothy L Moore MD
Représentants : Upton D Allen MD, Groupe canadien de recherche sur le sida chez les enfants; Charles PS Hui MD, représentant de la SCP auprès de Santé Canada, comité consultatif de la médecine tropicale et de la médecine des voyages; Nicole Le Saux MD, Programme canadien de surveillance active de l’immunisation; Larry Pickering MD, American Academy of Pediatrics; Marina I Salvadori MD, représentante de la SCP auprès de Santé Canada, comité consultatif national de l’immunisation
Auteurs principaux : Sarah ED Forgie MD; George Zhanel MD; Joan L Robinson MD
Références
- Zhanel GG, Palatnick L, Nichol KA, Low DE, Hoban DJ, The CROSS Study Group. Anitmicrobial resistance in Haemophilus influenzae and Moraxella catarrhalis respiratory tract isolates: Results of the Canadian Respiratory Organism Susceptibility Study, 1997-2002. Antimicrob Agents Chemother 2003;47:1875-81.
- Prymula R, Chlibek R, Splino M et coll. Safety of the 11-valent pneumococcal vaccine conjugated to non-typeable Haemophilus influenzae-derived protein D in the first 2 years of life and immunogenicity of the co-administered hexavalent diphtheria, tetanus, acellular pertussis, hepatitis B, inactivated polio virus, Haemophilus influenzae type B and control hepatitis A vaccines. Vaccine 2008;26:4563-70.
Avertissement: Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.
(retour au dossier initial)
(retour au dossier initial)

Aucun commentaire:
Enregistrer un commentaire